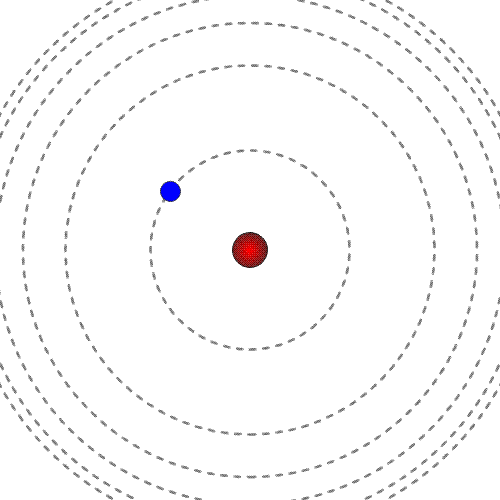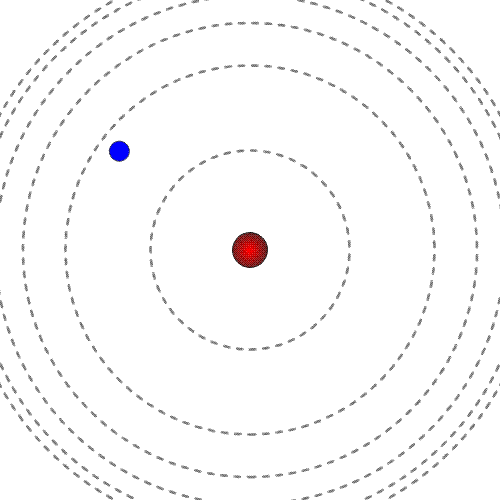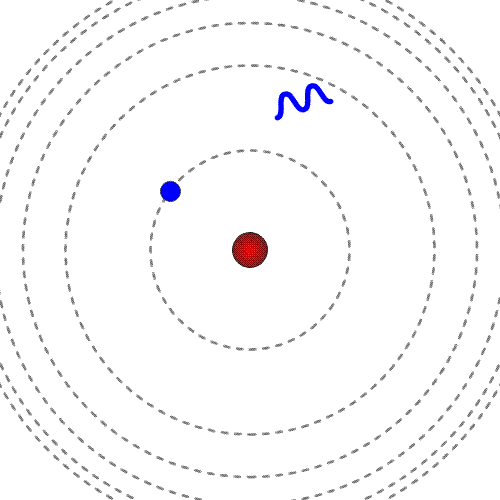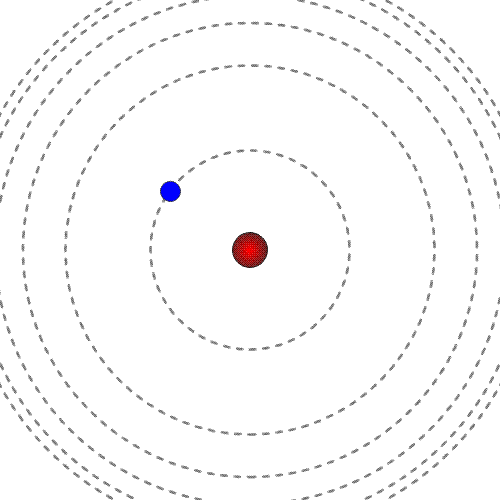
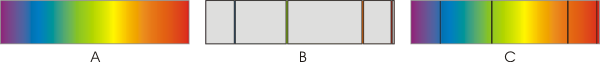
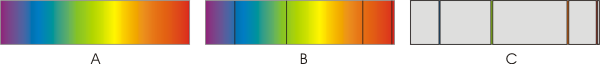
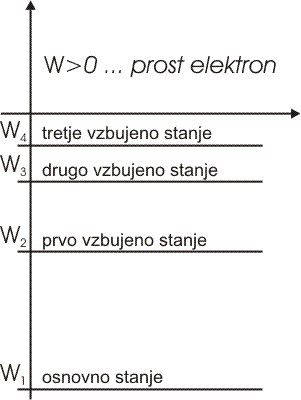
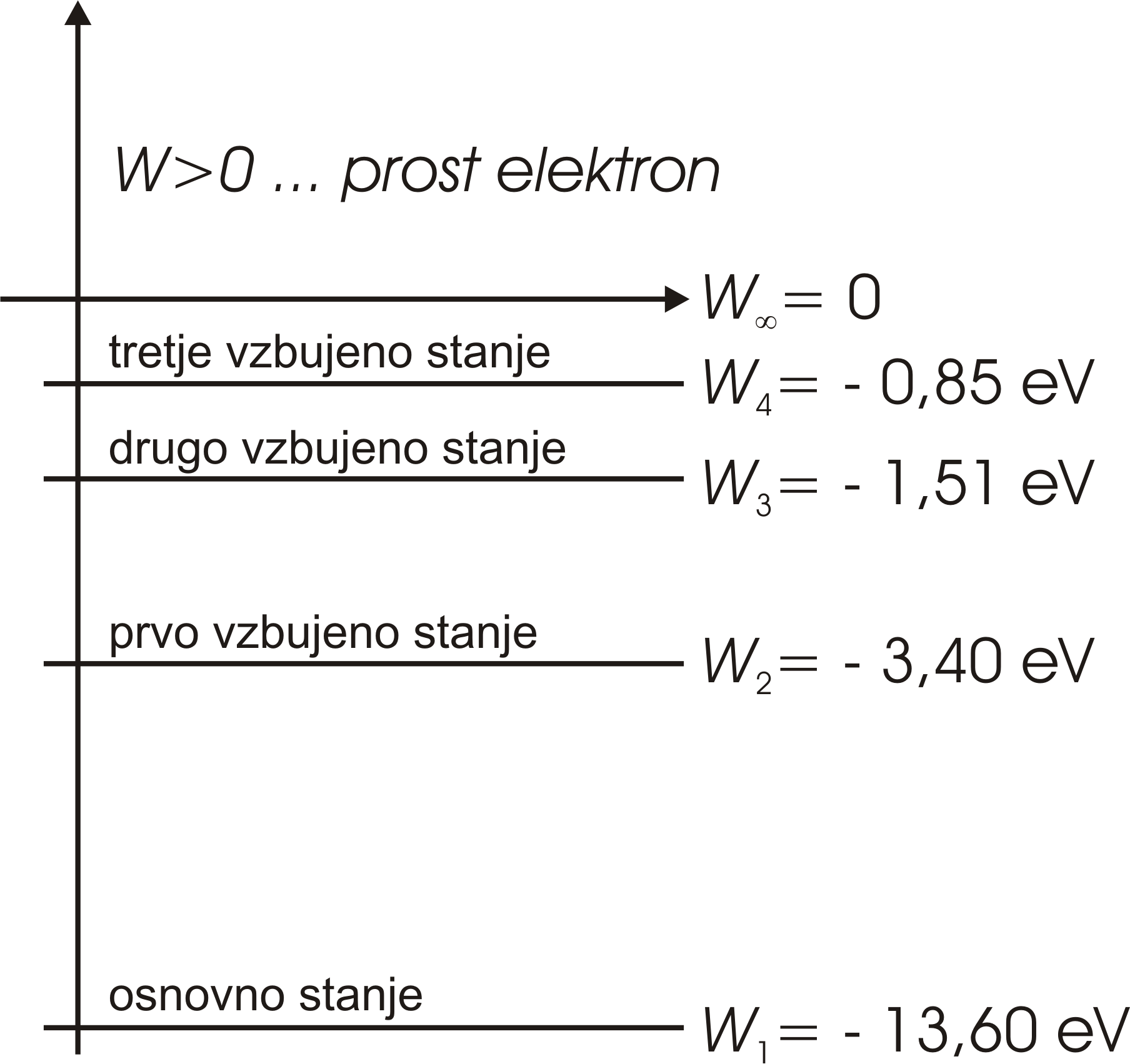
Prost elektron ima pozitivno energijo. Mirujoč elektron ima energija nič.
Energija elektrona, vezanega na jedro, je negativna in ne more imeti katerekoli vrednosti. Ker ima energija vezanega elektrona samo določene vrednosti, govorimo o diskretnih energijskih stanjih.
Manjša kot je energija (bolj kot je negativna), močneje je elektron vezan na jedro, bliže je jedru. Najnižjo energijo ima elektron, ko je v osnovnem energijskem stanju.