|
Želiš izvesti eksperiment s pomočjo delovnega lista? Preneseš si ga lahko tukaj:
Galvanski člen je naprava, ki pretvarja kemijsko energijo snovi neposredno v električno energijo s pomočjo kemijskih reakcij oksidacije in redukcije.
Energija eksotermne reakcije se pretvarja v električno energijo.
Z galvanskim členom pridobivamo enosmerni električni tok, ki ga lahko uporabimo za opravljanje dela. Sestavljen je iz dveh elektrod, pregrade med njima in elektrolita.
Vsaka baterija je sestavljena iz enega ali več galvanskih členov. Glavna razlika med posameznimi baterijami je v materialih, ki so uporabljeni za elektrodi oz. elektrolit. Različni materiali dajejo baterijam različne lastnosti. Le pri določenih vrstah uporabljenih materialov je možno obrniti kemijski proces, ki poteka pri praznjenju in s tem baterijo ponovno napolniti.
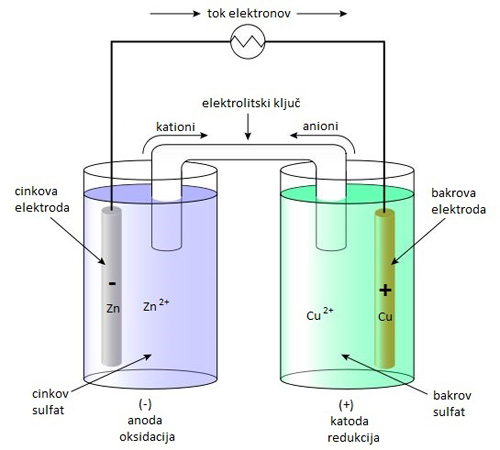
Primer enostavnega galvanskega člena je Daniellov člen, imenovan po njegovem izumitelju, Johnu Fridericu Daniellu (1790 – 1845), angleškemu kemiku in fiziku.
Vsak polčlen je sestavljen iz posode, v kateri je raztopina kovinskega iona, v njej pa je ploščica iz iste kovine. Negativno elektrodo predstavlja cink, pozitivno pa baker. Polčlena povežemo z elektrolitskim ključem.
Ko vzpostavimo zunanji tokokrog, stečejo elektroni iz negativne elektrode na pozitivno. Cinkova elektroda se pri tem raztaplja, baker pa izloča.
Skupna kemijska reakcija: Zn + Cu2+ → Zn2+ + Cu
|